- 2.52 MB
- 2022-04-29 14:37:57 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'《元素周期表》PPT课件
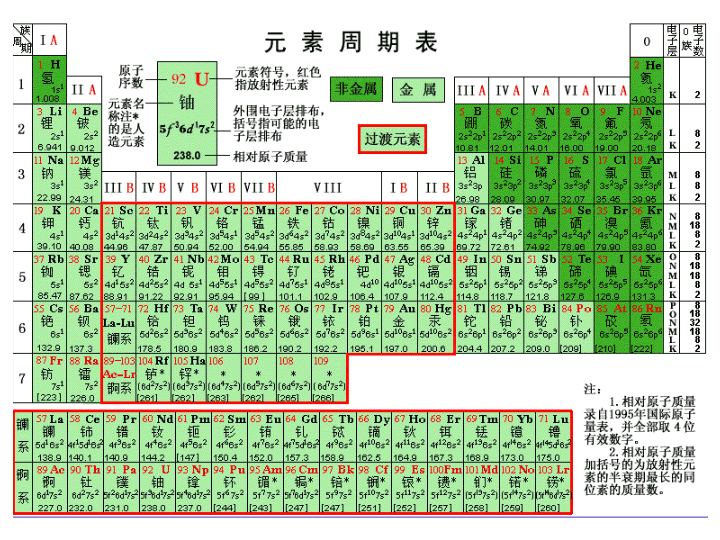
He2氦B5硼C6碳N7氮O8氧F9氟Ne10氖Al13铝Si14硅P15磷S16硫Cl17氯Ar18氩IIIAIVAVAVIAVIIA0Na11钠H1氢Li3锂Be4铍Mg12镁K19钾Ca20钙IAIIA1234A:主族B:副族
11211111010910810710610510489-10380797877767574737257-714847464544434241403930292827262524232221868584838281545352515049363534333231181716151413109876528887565538372019121143176541882MLk382LK22K11031021011009998979695949392919089717069686766656463626160595857元素周期表IAIIAIIIAIVAVAVIAVIIA0锕系镧系主族周期副族过渡元素
1、按照原子序数递增的顺序从左到右将电子层数相同的元素,按原子序数(质子数)从左到右排成一个横行为一个周期。2、把最外层电子数相同的元素按电子层数递增的顺序由上而下排成纵列——族一.元素周期表的编排原则:原子序数=核电荷数=质子数=核外电子数
主族副族:7个副族:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB第VⅢ族:0族:(“八、九、十”三个纵行)稀有气体元素7个主族:在罗马数字表示的族序数后面标“A”字。ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
判断下列说法是否正确错,还有0族元素错,短周期包括1、2、3周期,共18种元素正确,过渡元素全是金属元素1、短周期元素全是主族元素2、短周期元素共有20种元素3、过渡元素全是长周期元素4、过渡元素全是副族元素错,还有第VIII族元素
本节的基本规律(笔记):原子序数=核电荷数=质子数=核外电子数周期数=电子层数主族序数=最外层电子数各周期的元素数目:2,8,8,18,18,32,32稀有气体的原子序数:2,10,18,36,54,86.记住1~36号元素的名称和符号
根据原子序数推算主族元素在周期表中的位置将该原子序数同与之最相近的惰性元素的序数相减:1、若比相应惰性元素大1-2,则应处在下一周期的ⅠA-ⅡA2、若比相应惰性元素小1-5,则应处在同一周期的ⅦA-ⅢA,依次倒推各周期惰性元素序数:2、10、18、36、54、86
练习推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。第6号元素:6-2=4第二周期第ⅣA族。第13号元素:13-10=3第三周期第ⅢA族。第34号元素:34-36=-2第四周期第ⅥA族。第53号元素:53-54=-1第五周期第ⅦA族。第88号元素:88-86=2第七周期第ⅡA族。第82号元素:82-86=-4第六周期第ⅣA族。
第三周期第IVA族的元素原子序数是:Na元素的原子序数为11,相邻的同族元素的原子序数是:短周期元素中,族序数=周期序数的元素有:族序数等于周期序数2倍的元素有:周期序数=族序数2倍的有:练习与思考:143、19H、Be、AlCSLi、Ca
元素周期表周期(7个)短周期(3个):第1.2.3周期长周期(3个):第4.5.6周期不完全周期(1个):第7周期族(16个)主族(7个)ⅠA~ⅦA副族(7个)ⅠB~ⅦBⅧ族第8910三个纵列零族稀有气体元素元素周期表的整体结构过渡元素
物质的结构决定物质的性质,物质的结构相似则其性质必然相似;物质的结构呈规律性递变则性质也必然呈规律性递变。元素的化学性质主要决定于原子核外最外层电子数,同时与原子半径也有密切关系。一、碱金属(第一主族除氢外的金属)化学性质的相似性和递变性(1)金属性最强的是在左下角,铯。离铯近的金属性强。(2)金属性越强,其单质与水置换氢气越容易,越剧烈。
②从上到下,由于电子层数递增,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减弱,原子失电子能力逐渐增强,因此,碱金属元素的金属性逐渐增强,单质的还原性逐渐增强,氢氧化物的碱性逐渐增强。(3)金属性越强,其最高价氧化物的水化物碱性越强碱性:KOH›NaOH(离铯近的碱性强)
碱金属的主要物理性质
二、卤族元素(代表非金属)——FClBrI(VIIA族)(1)卤素单质都是有色物质,从上到下,其颜色逐渐加深,密度逐渐增大,熔、沸点逐渐升高(常温时的状态由气态经液态到固态)。(2)非金属性最强的元素在右上角,氟。离氟近的元素非金属性较强(得电子能力、氧化性),非金属性越强,其单质与氢气化合越容易,越剧烈,生成的氢化物越稳定(正易逆难)。(3)非金属性越强,其最高价氧化物的水化物酸性越强(离氟越近,酸性越强)HClO4>HBrO4>HIO4(F、O无正价,因此无最高价氧化物的水化物)单质均为双原子分子——X2
原因:同主族元素的性质具有相似性和递变性,是因为同主族元素的原子结构具有相似性和递变性。结论(记)同主族元素从上到下,金属性逐渐增强,非金属性逐渐减弱。
学习目的:掌握卤族元素的性质与原子结构的关系卤族元素
画出周期表的短周期部分HLiNaBeMgBAlCSiOSFClHeNeArIAIIAIIIAIVAVAVIAVIIA0NP画出Cl原子结构示意图
F972Cl1773Br3574I5375At8576+972+17287+3528187+532818187+85281832187VIIA
思考根据卤素的原子结构,请你推测氟、氯、溴、碘在化学性质上所表现的相似性和递变性。
逐渐增大逐渐减弱逐渐减弱逐渐减弱逐渐增多逐渐减弱相同最外层电子数是7
Br2+H2O==HBr+HBrO反应越来越难以发生2F2+2H2O==4HF+O2(特例)Cl2+H2O==HCl+HClO卤素与水的化学反应方程式通式:X2+H2O==HX+HXO(X:Cl、Br、I)
冷暗处爆炸H2+F2==2HFHF很稳定光照或点燃H2+Cl2==2HClHCl稳定高温H2+Br2==2HBrHBr较不稳定高温、持H2+I2==2HIHI很不稳定续加热500℃光照卤素与氢气的反应点燃
卤素单质间的置换反应F2+2NaCl(熔融)=2NaF+Cl2Cl2+2NaBr=2NaCl+Br2Cl2+2KI=2KCl+I2Br2+2KI=2KBr+I2F2Cl2Br2I2氧化性逐渐减弱
核素1、原子的构成
原子学说发展史1、公元前5世纪,希腊哲学家德谟克利特等人认为:万物是由大量的不可分割的微粒构成的,即原子。
2、19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
1897年,英国科学家汤姆生发现了电子。
人类探索自然的努力自古就有,并且也从没有停止。前辈为人类认识世界,进而改造世界,作出了突出的贡献,为我们留下的不只是物质财富,还有巨大的精神财富,在他们的精神感召下,我们难道不应加倍努力学习吗?
氦原子结构示意图质子22+e-e-电子中子三、核素:(一)原子的结构:1、原子原子核核外电子质子中子{{
质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电
构成原子的粒子及其性质
请同学们回忆:相对原子质量请同学们推论:一个质子的相对质量如何计算?m(12C)=1.993×10-26Kg1/12m(12C)=(1.661×10-27Kg)以12C原子质量的1/12作为标准,其他原子的质量跟它比较所得的值。
构成原子的粒子及其性质1.0071.0081/1836
相对原子质量=(电子总质量+质子总质量+中子总质量)/原子质量的12分之一C12=×电子数+质子数×1.007+中子数×1.0081/1836≈质子数+中子数=质量数
归纳与整理2、质量数与质子数和中子数间的关系。质量数:原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值。质量数(A)=质子数(Z)+中子数(N)核电荷数=核内质子数=原子核外电子数
a——代表质量数;b——代表核电荷数;c——代表离子的价态;d——原子个数abcd各代表什么?学了这部分内容后常见到这样的符号abXc+d
1.钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?(11,11)2.硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?(33)解:因为S2-的核外电子数是18,即硫原子得到2个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。课堂练习
课堂练习3、X元素原子的质量数为m,核内中子数为n,则WgX+含有电子的物质的量(mol)是(提示:元素的相对原子质量近似等于质量数)A.(m-n)×W/mB.(m-n-1)×W/mC.(m+n)×W/mD.(m-n+1)×W/mB
氢元素的三种原子氕氘氚HDT重氢超重氢
三种不同的氢原子①②③101112
这三种微粒是同一种原子吗?是同一种元素吗?可见它们是氢元素的三种不同原子,把这三种原子叫核素.把这三种原子互称为同位素.
2、核素:具有一定数目的质子和一定数目中子的一种原子1、元素:具有相同核电荷数(质子数)的同一类原子。同种元素:原子的原子核中质子数______。同种元素:原子的原子核中中子数可以_____。同种元素:可以有______种不同原子。相同不相同[归纳与整理](二)元素、核素、同位素:几再如:C12C14
3、同位素把原子里具有相同质子数和不同中子数的原子互称为同位素。即:两同(同质子数、同一元素)两不同(中子数不同、原子不同)其特点为:⑴同位素在周期表里占据同一位置。⑵同位素的化学性质几乎完全相同,物理性质略有差异。⑶在天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子个数百分比(丰度)一般为定值。
⑷同种元素的不同的同位素原子也可 组成不同的单质或化合物的分子。如:氢:氕、 氘、 氚氢 重氢 超重氢元素符号:HHH原子符号:11H12H13HHDT单质:与氧化合成水:这些水分子的最大式量_____,最小式量_____,共有___种式量。22518H2、D2、T2、H-D、H-T、D-TH2O、D2O、T2O、HDO、DTO、HTO
课堂练习4、在(1)Li、(2)N、(3)Na、 (4)Mg、(5)Li、(6)C中:(1)和互为同位素。(2)和质量数相等,但不能互称同位素。(3)和的中子数相等,但质子数不相等,所以不是同一种元素。(1)(5)(2)(6)(3)(4)
思考:下列符号代表几种元素?几种原子?4018Ar4019K4220Ca4119K4020Ca4019K+三五
(1)原子质量(2)相对原子质量(原子量)(3)原子质量数(4)同位素原子量(5)元素的相对原子质量(即平均原子量)(6)元素的近似相对原子质量(三)相对原子质量课堂延伸
Cl元素相对原子质量=M1×a1+M2×a2=34.969×75.77%+36.966×24.23%=35.453例:Cl元素相对原子质量的计算Cl元素近似相对原子质量=A1×a1+A2×a2=35×75.77%+37×24.23%=35.48535×75%+37×25%=35.5(进一步对丰度作近似处理)
1.设某元素的原子核内的质子数为m,中子数为n,则下述论断正确的是()A.不能由此确定该元素的相对原子质量B.这种元素的相对原子质量为(m+n)g
C.碳原子质量为wg,此原子的质量为(m+n)wgD.核内中子的总质量小于质子的总质量2.硼有两种天然同位素,10B和11B,近似原子量为10.8,求10B和11B在天然同位素中的原子个数比为。10B和11B的质量比(填大于、小于、等于1:4)A1:4小于
【拓展练习】某元素x的同位素可形成三种双原子分子,其式量分别为158、160、162,其分子个数比为1:2:1,问:⑴元素x有几种同位素?⑵质量数分别是多少?⑶计算各同位素的所占原子百分比。一种原子(A)AAA21种 分子2种同位素ABAA2ABBABB23种分子3种同位素ABCAA2ABACBABB2BCCACBCC26种分子故:A、B质量数分别为79和81。⑴x有两种同位素A2ABB2⑵⑶两同位素所占原子百分组成均为50%
再见!
大家好
你
将
看
到
我的
自我介绍
自我介绍
自我介绍
自我
介绍
我叫
XXx
XX
这
是
我
第一次
第一次
做
快闪
快闪
快闪
快闪
快闪
快闪
快闪
快闪
类型的ppt
我喜欢和大家玩
我们来玩一个小游戏
小游戏
小游戏
你的眼睛受得了
受得了
这种
刺激
刺激
吗?
累死狗!
还在吗
如果觉得此模板不错
请点个赞
赞
不喜欢的话
那就
点一个踩吧
谢谢!'
您可能关注的文档
- 最新《假如没有灰尘》ppt课件课件PPT.ppt
- 最新《假分数化成整数或带分数》课件PPT教学讲义ppt.ppt
- 最新《信号与系统》第八章--考研及期末考试课件PPT.ppt
- 最新《信号分析与处理(第3版)》赵光宙(电子课件)第5章-1课件PPT.ppt
- 最新《做阳光少年主题班会》课件PPT课件.ppt
- 最新《做框架》课件PPT课件.ppt
- 最新《做个“开心果”》PPT课件PPT.ppt
- 最新《假设检验》PPT课件-(2)(1)课件PPT.ppt
- 最新《光合作用的过程》课件(人教版必修1)Ada课件PPT.ppt
- 最新《元素与物质世界》PPT课件PPT课件.ppt
- 最新《儿童乐园》课件资料课件PPT.ppt
- 最新《公民基本权利》课件PPT课件.ppt
- 最新《公平》主题班会课件PPT.ppt
- 最新《全自动血细胞分析仪》实验教学多媒体课件PPT课件.ppt
- 最新《养成良好的行为习惯》主题班会ppt课件PPT.ppt
- 最新《养成良好的行为习惯》ppt课件课件PPT.ppt
- 最新《关雎》优秀课件PPT课件.ppt
- 最新《关雎》ppt课件PPT.ppt