- 3.51 MB
- 2022-04-29 14:19:27 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'紫外可见分光光度法(精)
第一节基本原理一、光的基本特性1.光的波动性光是一种电磁波,电磁波可以用周期T(s)、频率ע(Hz)、波长λ(nm)和波数σ(cm-1)等参数描述。它们之间的关系为:ע=1/T=c/λσ=1/λ=ע/c
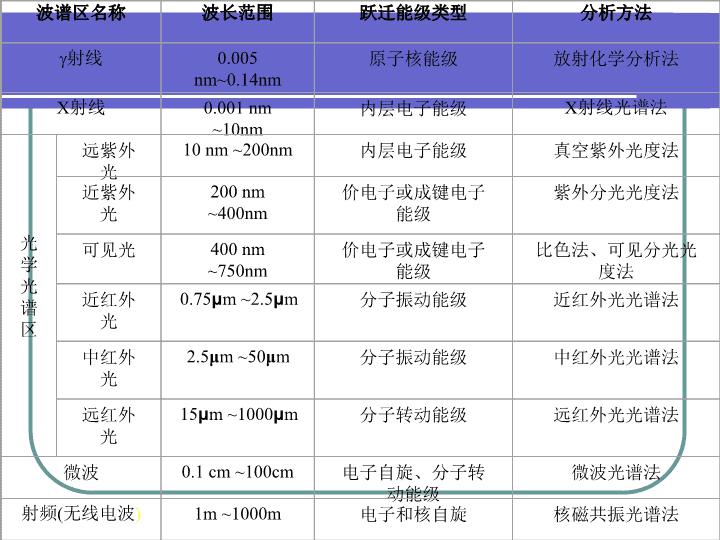
波谱区名称波长范围跃迁能级类型分析方法射线0.005nm~0.14nm原子核能级放射化学分析法X射线0.001nm~10nm内层电子能级X射线光谱法光学光谱区远紫外光10nm~200nm内层电子能级真空紫外光度法近紫外光200nm~400nm价电子或成键电子能级紫外分光光度法可见光400nm~750nm价电子或成键电子能级比色法、可见分光光度法近红外光0.75μm~2.5μm分子振动能级近红外光光谱法中红外光2.5μm~50μm分子振动能级中红外光光谱法远红外光15μm~1000μm分子转动能级远红外光光谱法微波0.1cm~100cm电子自旋、分子转动能级微波光谱法射频(无线电波)1m~1000m电子和核自旋核磁共振光谱法
不同颜色的可见光波长及其互补光红650~760绿蓝橙610~650蓝黄580~610紫黄绿560~580红紫绿500~560红蓝绿490~500橙绿蓝480~490黄蓝450~480黄绿紫400~450互补光颜色/nm蓝绿互补色光和各种颜色光的波长范围,可作为光度测定时选择测量波长的参考
蓝黄紫红绿紫黄绿绿蓝橙红蓝绿图中处于对角线上的两种单色光为互补色光。例如蓝色光和黄色光、绿色光和紫红色光互补等
二、光与物质的作用1.光的吸收物质粒子如原子、分子、离子等总是处于特定的不连续的能量状态,各状态对应的能量称为能级,用E表示。基态E0,激发态EjEL=hע=△E(能级差)【例1-2】P3
2.物质颜色的产生物质的颜色是由于物质对不同波长的光具有选择性吸收而产生的。白光青蓝青绿黄橙红紫蓝
一种物质呈现何种颜色,与入射光组成和物质本身的结构有关,而溶液呈现不同的颜色是由于溶液中的吸光质点(离子或分子)选择性地吸收某种颜色的光而引起的。常见的有下列三种情况:③如果对某种色光产生选择性吸收,则溶液呈现透射光的颜色,即溶液呈现的是它吸收光的互补色光的颜色。如硫酸铜溶液选择性地吸收了白色光中的黄色光,所以呈现蓝色。①当白光通过某一均匀溶液时,如果各种波长光几乎全部被吸收,则溶液呈黑色。②如果入射光全部透过(不吸收),则溶液无色透明。
溶液的颜色与光吸收的关系完全吸收完全透过吸收黄色光光谱示意表观现象示意复合光物质呈现颜色与吸收光波长的关系见下表。
三、光谱吸收曲线1.紫外-可见吸收光谱产生的机理光子作用于物质分子时,如果光子的能量与物质分子的电子能级间的能级差满足△E=hע光子将能量传递给物质分子,分子获得能量可发生电子能级的跃迁。在光吸收过程中基于分子中电子能级的跃迁而产生的光谱,称为紫外-可见吸收光谱(或电子光谱)。
吸收曲线:测定某种物质对不同波长单色光的吸收程度,以波长为横坐标,吸光度为纵坐标作图。KMnO4的吸收曲线最大吸收波长,max定量分析的基础:某一波长下测得的吸光度与物质浓度关系的有关
2、吸收光谱或吸收曲线任何一种溶液对不同波长光的吸收程度是不一样的。若以不同波长的光照射某一溶液,并测量每一波长下溶液对光的吸收程度(即吸光度A),以吸光度为纵坐标,相应波长为横坐标,所得A-λ曲线,称为吸收曲线。它更清楚地描述了物质对光的吸收情况。四种不同浓度KMnO4溶液的吸收曲线
300400500600700/nm350525545Cr2O72-MnO4-1.00.80.60.40.2Absorbance350Cr2O72-、MnO4-的吸收曲线
吸收曲线的讨论:(1)同一种吸光物质对不同波长的光吸收程度不同。吸光度最大处对应的波长称为最大吸收波长λmax。吸收曲线是定量分析中选择入射光波长的重要依据。(2)同一种物质浓度不同,其吸收曲线形状相似λmax不变。在λmax处,吸光度A正比于浓度C。测定最灵敏。
(3)不同物质吸收曲线的特性不同。吸收曲线的特性包括曲线的形状、峰的数目、峰的位置和峰的强度等。它们与物质特性有关,吸收曲线可以提供物质的结构信息,并作为物质定性分析的依据之一。
四、光吸收定律当一束平行单色光,通过一均匀的溶液后,光的强度会减弱。I0=Ia+It入射光强度吸收光强度透过光强度
透光度T(透射比)Transmittance定义透光度:T取值为0.0~1.0全部吸收~~~~全部透射A=lg(1/T)=-lgT吸光度A(Absorbance)A取值为0.0~∞全部透射~~~全部吸收二者关系为:定义吸光度:
2.朗伯-比尔定律朗伯-比尔定律:当一束平行单色光通过含有吸光物质的稀溶液时,溶液的吸光度与吸光物质浓度、液层厚度乘积成正比,即A=κbc式中比例常数κ与吸光物质的本性,入射光波长及温度等因素有关。K可用a(吸光系数)或ε(摩尔吸光系数)表示。c为吸光物质浓度,b为透光液层厚度。朗伯-比尔定律是紫外-可见分光光度法的理论基础。
2.朗伯-比尔定律朗伯和比尔分别研究了吸光度与液层厚度和吸光度与浓度之间的定量关系,合称朗伯-比尔定律,其数学表达式为:吸光度吸收层厚度(cm)吸光质点浓度A=lg(I0/It)=κbc物理意义:当一束平行单色光通过均匀、透明的吸光介质时,其吸光度与吸光质点的浓度和吸收层厚度的乘积成正比——吸光光度法定量分析的理论基础
比例常数的取值与浓度的单位有关比例常数入射光波长物质的性质温度吸光系数与摩尔吸光系数A=kbc①当c的单位为g·L-1时,比例常数用a表示,称为质量吸光系数A=abρ②当c的单位用mol·L-1时,比例常数用ε表示,称为摩尔吸光系数A=εbca的单位:L·g-1·cm-1ε的单位:L·mol-1·cm-1ε=MaM—物质的摩尔质量
摩尔吸光系数的物理意义:溶液浓度为1mol/L、液层厚度为1cm时物质对光的吸收程度(1)吸收物质在一定波长和溶剂条件下的特征常数(2)不随浓度c和液层厚度b的改变而改变。在温度和波长等条件一定时,ε仅与吸收物质本身的性质有关,与待测物浓度无关;(3)同一吸光物质在不同波长下的ε值是不同的。在最大吸收波长λmax处的摩尔吸光系数,常以εmax表示εmax表明了该吸收物质最大限度的吸光能力。
3.朗伯-比尔定律的应用条件朗伯-比尔定律不仅适用于紫外光、可见光,也适用红外光;在同一波长下,各组分吸光度具有加和性A=A1+A2++An(1)入射光必须为单色光(2)被测样品必须是均匀介质(3)在吸收过程中吸收物质之间不能发生相互作用。
定量分析时,通常液层厚度是相同的,按照比尔定律,浓度与吸光度之间的关系应该是一条通过直角坐标原点的直线。但在实际工作中,往往会偏离线性而发生弯曲。4.偏离朗伯一比尔定律的原因
(1)比尔定律的局限性比尔定律假设了吸收粒子之间是无相互作用的,因此仅在稀溶液(c<10-2mol/L)的情况下才适用。在高浓度时,由于吸光物质的分子或离子间的平均距离减小,是相邻的吸光粒子的电荷分布互相影响,从而改变了它对光的吸收能力。
吸收定律成立的前提条件之一是入射光为单色光,但实际上难以获得真正的纯单色光。在实际工作中,为了避免非单色光带来的影响,一般选用峰值波长进行测定。分光光度计只能获得近乎单色的狭窄光带,而复合光可导致对朗伯—比耳定律的正或负偏离。选用峰值波长,也可以得到较高的灵敏度。(2)非单色光引起的偏离
(3)溶液本身发生化学变化溶液中存在着离解、聚合、互变异构、配合物的形成等化学平衡时,使吸光质点的浓度发生变化,影响吸光度。当溶液浓度c>10-2mol/L时,吸光质点间可能发生缔合等相互作用,直接影响了对光的吸收。故:朗伯—比耳定律只适用于稀溶液例:铬酸盐或重铬酸盐溶液中存在下列平衡:2CrO42-+2H+=Cr2O72-+H2O溶液中CrO42-、Cr2O72-的颜色不同,吸光性质也不相同。故此时溶液pH对测定有重要影响。
例:显色剂KSCN与Fe3+形成红色配合物Fe(SCN)3,存在下列平衡:Fe(SCN)3Fe3++3SCN-溶液稀释时一倍时,上述平衡向右,离解度增大。所以Fe(SCN)3的浓度不止降低一半,故吸光度降低一半以上,导致朗伯—比尔定律偏离。
第二节化合物的紫外—可见吸收光谱一、有机化合物的紫外—可见吸收光谱1、有机化合物的电子跃迁有机化合物的紫外吸收光谱,取决于分子中外层电子的性质。有机化合物分子中通常有三类电子,σ电子、π电子、n电子
即形成单键的σ电子、形成不饱和键的π电子以及未参与成键的n电子(孤对电子)。处于基态的分子在吸收一定波长的光后,分子中的成键电子和非键电子可被激发跃迁至σ*和π*反键轨道
有机化合物的紫外—可见吸收光谱,是其分子中外层价电子跃迁的结果:分子轨道理论:一个成键轨道必定有一个相应的反键轨道。通常外层电子均处于分子轨道的基态,即成键轨道或非键轨道上。
其跃迁类型有σ→σ*、n→σ*、π→π*和n→π*四种,其相对能量大小次序为:σ→σ*>n→σ*>π→π*>n→π*有机物最有用的吸收光谱是基于n→π*和π→π*跃迁而产生的。
⑴ σ→σ*跃迁所需能量最大,σ电子只有吸收远紫外光的能量才能发生跃迁。饱和烷烃的分子吸收光谱出现在远紫外区(吸收波长λ<200nm,只能被真空紫外分光光度计检测到)。如甲烷的λmax为125nm,乙烷λmax为135nm。
⑵ n→σ*跃迁所需能量较大。吸收波长为150~250nm,大部分在远紫外区,近紫外区仍不易观察到。含非键电子的饱和烃衍生物(含N、O、S和卤素等杂原子)均呈现n→σ*跃迁。如一氯甲烷、甲醇、三甲基胺n→σ*跃迁的λmax分别为173nm、183nm和227nm。
⑶π→π*跃迁所需能量较小,吸收波长处于远紫外区的近紫外端或近紫外区,摩尔吸光系数εmax一般在104L·mol-1·cm-1以上,属于强吸收。不饱和烃、共轭烯烃和芳香烃类均可发生该类跃迁。如乙烯π→π*跃迁的λmax为162nm,εmax为:1×104L·mol-1·cm-1。
⑷n→π*跃迁需能量最低,吸收波长λ>200nm。这类跃迁在跃迁选律上属于禁阻跃迁,摩尔吸光系数一般为10~100L·mol-1·cm-1,吸收谱带强度较弱。分子中孤对电子和π键同时存在时发生n→π*跃迁。丙酮n→π*跃迁的λmax为275nmεmax为22L·mol-1·cm-1(溶剂环己烷)。
(1)生色团(发色团):把含π键的结构单元称为生色团。有机化合物中具有n电子和π电子的基团产生n→π*跃迁和π→π*跃迁,跃迁E较低例:C=C;C=O;C=N;—N=N—
2.常用术语1、生色团与助色团生色团(chromophore):在紫外和可见光区产生吸收带的基团称为生色团。因为只有由π→π*和n→π*跃迁才能产生紫外可见吸收,而这两种跃迁均要求有机物分子中含有不饱和基团,所以这类含有π键的不饱和基团称为生色团。简单的生色团由双键或叁键体系组成,如乙烯基、羰基、亚硝基、偶氮基—N=N—、乙炔基、腈基—C≡N等。
助色团(auxochrome):有一些含有n电子的基团(如—OH、—OR、—NH2、—NHR、—X等),它们本身没有生色功能(不能吸收λ>200nm的光),但当它们与生色团相连时,就会发生n—π共轭作用,增强生色团的生色能力(吸收波长向长波方向移动,且吸收强度增加),这样的基团称为助色团。
如苯环的一个氢原子被一些基团取代后,苯环在254nm处的吸收带的最大吸收位置和强度就会改变。
化合物取代基苯254300氯苯264320溴苯262325苯酚2731780苯甲醚2722240
(2)红移和蓝移:由于化合物结构变化(共轭、引入助色团取代基)或采用不同溶剂后吸收峰位置向长波方向的移动,叫红移(长移)吸收峰位置向短波方向移动,叫蓝移(紫移,短移)
3.影响紫外-可见吸收光谱的因素物质的吸收光谱与测定条件有密切的关系。测定条件(共轭效应、溶剂极性、pH等)不同,吸收光谱的形状、吸收峰的位置、吸收强度等都可能发生变化。
(1)共轭效应当一个分子中含有两个或两个以上的生色团时,按相互间的位置可以分为共轭和非共轭两种情况:非共轭时,各个生色团各自独立吸收,吸收带由各生色团的吸收带叠加而成;
共轭后,π电子运动范围大,π*轨道能量降低,π→π*跃迁能级差减小,吸收光谱红移,ε(摩尔吸光系数)值增大。共轭不饱和键数目越多,红移越显著。下表列出了一些有关共轭结构的化合物
化合物共轭双键数11955000220010000221721000325425000325835000
(2)溶剂效应溶剂不同,同一种物质得到的光谱可能不一样,这种现象称为溶剂效应。随着极性增加,π→π*跃迁的吸收波长变大,n→π*跃迁的吸收波长变小。见P10表1-7
ππ*nππ*n△En→π*△Eπ→π*△En→π*△Eπ→π*无溶剂化作用有溶剂化作用蓝移:△En→π*<△En→π*红移:△Eπ→π*>△Eπ→π*△En→π*△Eπ→π*△En→π*△Eπ→π*
(3.)溶液的PHE2BPh-OHPh-O-210(6200)235(9400)270(1450)287(2600)Ph-NH2Ph-NH3+230(8600)203(7500)280(1430)254(169)
4、常见有机化合物的紫外-可见吸收光谱(1)饱和烃及其取代衍生物烷烃C—C,C—H只产生σ→σ*跃迁,λmax<150nm,在近紫外区无吸收。因而饱和烷烃可用作紫外吸收测定的溶剂。如,CH4λmax=125nm;CH3CH3λmax=135nm
饱和烃上H被杂原子取代σ→σ*红移,并产生n→σ*跃迁。n→σ*仍在远紫外区;某些n→σ*可以在近紫外区产生吸收。CH4:σ→σ*124nm,CH3I:n→σ*259nm
部分含杂原子的饱和化合物n→σ*吸收化合物λmaxεmax溶剂甲醇177200己烷1-己硫醇224126环己烷三甲基胺199395己烷氯代甲烷173200己烷溴代甲烷208300己烷
(2)不饱和烃及共轭烯烃σ、π:σ→σ*跃迁、π→π*跃迁单个双键,隔离双键:π→π*跃迁,吸收峰在远紫外区,乙烯175nm,1,5-己二烯185nm烯碳上取代基数目增加,λmax红移。
共轭双键:π→π*跃迁红移,增色,共轭双键中π→π*跃迁所产生的吸收带称为K带,其特点是强度大(ε>104),λmax≥217nm,K带的λmax、εmax与共轭体系的数目、位置、取代基的种类有关。双键与带n电子的杂原子相连:由于n→π共轭,π→π*跃迁能量减小,波长红移。
(3)芳香族化合物苯:具有环状共轭体系,由π→π*产生三个吸收带:E1184nm4.7×104E2203nm7.9×103B255-230nmB带是由于π→π*跃迁和苯环的振动重叠引起,也称为精细结构吸收带。B带是芳香族化合物的重要特征吸收带。
(4)羰基化合物n→π*、n→σ*、π→π*其中n→σ*、π→π*跃迁的λmax<200nm,n→π*跃迁λmax270-300nm(ε<100),是羰基化合物(双键上有杂原子)的特征吸收带,称为R带。
几种特征吸收带K吸收带、共轭双键中π→π*跃迁所产生的吸收带称为K带,其特点是强度大(ε>104),λmax在217-280nm范围,共轭体系数目越多,深色移动显著。E1、E2带、具有环状共轭体系,由π→π*产生的吸收带。强吸收带。苯的E1λmax185nm。E2λmax204nm。一般在210nm左右。
B带、具有环状共轭体系是由于π→π*跃迁和苯环的振动重叠引起,也称为精细结构吸收带。B带是芳香族化合物的重要特征吸收带。较弱吸收(ε<200),λmax230-270nm。R带、是由于n→π*跃迁产生的λmax270-300nm,弱吸收(ε<100),是羰基化合物(双键上有杂原子)的特征吸收带,称为R带。
1.电荷迁移跃迁:与有机物类似,电子从给予体向与接受体相联系的轨道上跃迁,发生在近紫外线区与可见光区之间。hvhv电子接受体电子给予体Mn+____Lb-M(n-1)+____L(b-1)-Cl-____(H2O)nCl____(H2O)n-hvFe3+____OH-hv[Fe3+____CNS-]2+Fe2+____OH[Fe2+____CNS]2+εmax≥104,是强吸收带二、无机化合物的紫外-可见吸收光谱
2.配位场跃迁f电子跃迁吸收光谱镧系和锕系元素的离子对紫外和可见光的吸收是基于内层f电子的跃迁而产生的。其紫外可见光谱为一些狭长的特征吸收峰,这些峰几乎不受金属离子的配位环境的影响。
2.配位体场跃迁A.f→f跃迁镧系------4f锕系------5f由于f轨道被具有高量子数的外层轨道所屏蔽,受外界影响较小,并且不易受外层电子有关的键合性质的影响。εmax<100,是弱吸收带因此,呈现窄带吸收
d电子跃迁吸收光谱过渡金属的电子跃迁类型为d电子在不同d轨道间的跃迁,吸收紫外或可见光谱。这些峰强烈受配位环境的影响。例如cu2+以水为配位体,吸收峰在794nm处,而以氨为配位体,吸收峰在663nm处。此类光谱吸收强度弱,较少用于定量分析。
B.d→d跃迁
练习题1.光量子的能量正比于辐射的:A:频率 B:波长. C:波数.D:传播速度 E周期2.电子能级间隔越小,跃迁时吸收光子的A:能量越大 B:波长越长. C:波数越大 D:频率越高E:以上A、B、C、D、都对
3.同一电子能级,振动态变化时所产生的光谱波长范围是:A:可见光区 B:紫外光区 C:红外光区. D:X射线光区 E:微波区4.所谓真空紫外区,其波长范围是:A:200~400nm.B:400~800nmC:10~200nmD:103nm
5.下面五个电磁辐射区域:A:X射线区 B:红外区 C:无线电波D:可见光区 E:紫外光区请指出(1)能量最大者(2)波长最短者(3)波数最小者 (4)频率最小者6.以下五种类型的电子能级跃迁,需要能量最大的是:
第三节紫外-可见分光光度计的结构与原理一、主要部件
一、主要组成元件光源单色器样品室检测器显示
1、光源在整个紫外光区或可见光谱区可以发射连续光谱,具有足够的辐射强度、较好的稳定性、较长的使用寿命。可见光区:钨灯作为光源,其辐射波长范围在320~2500nm。紫外区:氢、氘灯。发射185~400nm的连续光谱。
2、单色器将光源发射的复合光分解成单色光并可从中选出一任波长单色光的光学系统。棱镜:玻璃350~3200nm,石英185~400nm光栅:波长范围宽,色散均匀,分辨率高,使用方便
3.吸收池:(比色皿)用于盛待测及参比溶液。可见光区:光学玻璃池,有0.5cm1.0cm2.0cm3.0cm等规格。紫外区:石英池4.检测器:利用光电效应,将光能转换成电流信号。光电池,光电管,光电倍增管5.指示器:低档仪器:刻度显示中高档仪器:数字显示,自动扫描记录
返回氙灯氢灯钨灯
棱镜:依据不同波长光通过棱镜时折射率不同单色器入射狭缝准直透镜棱镜聚焦透镜出射狭缝白光红紫λ1λ2800600500400
光栅:在镀铝的玻璃表面刻有数量很大的等宽度等间距条痕(600、1200、2400条/mm)。M1M2出射狭缝光屏透镜平面透射光栅光栅衍射示意图原理:利用光通过光栅时发生衍射和干涉现象而分光.返回
吸收池
光电管(Phototube)h(片)红敏管625-1000nm蓝敏管200-625nm
数据处理
二、分光光度计的类型
第四节紫外-可见吸收光谱的应用紫外-可见吸收光谱除主要可用于物质的定量分析外,还可以用于物质的定性分析、纯度鉴定、结构分析。一.定性分析1、未知化合物的定性鉴定每一种化合物都有自己的特征光谱。测出未知物的吸收光谱,原则上可以对该未知物作出定性鉴定,但对复杂化合物的定性分析有一定的困难。在相同的实验条件(仪器条件、溶剂)下,将未知物的紫外光谱与标准物质的紫外光谱进行比较,若两者谱图相同,可认为含有相同的生色团,但不一定是相同的物质。
2.纯度的鉴定用紫外吸收光谱确定试样的纯度是比较方便的。如苯256nm处有B带,而甲醇乙醇无吸收带,可鉴定其纯度。3.结构分析紫外-可见吸收光谱一般不用于化合物的结构分析,但利用紫外吸收光谱鉴定化合物中的共轭结构和芳环结构还是有一定价值。例如,某化合物在近紫外区内无吸收,说明该物质无共轭结构和芳香结构。
二、定量分析1.单组分的定量分析(1)吸光系数法(绝对法)【例1-4】P17(2)标准对照法As=kbCsAx=kbCsCs=AsCx/Ax
(3)标准曲线法配制一系列浓度不同的标准溶液,分别测定其吸光度,用吸光度对浓度作图。再测定未知液的吸光度Ax,从工作曲线上查得其浓度。cAAxcx
2、多组分的定量分析a不重叠b重叠
第五节实验技术一样品的制备二仪器测量条件的选择、吸光度测条1.选择适当的入射波长一般应该选择λmax为入射光波长。但如果λmax处有共存组分干扰时,则应考虑选择灵敏度稍低但能避免干扰的入射光波长。
2、吸光度范围的选择仪器光源不稳定、实验条件的偶然变动、读数精度变动等都会带来测量误差。光度分析误差化学因素仪器因素浓度测量的相对误差与T(或A)的关系:仪器读数误差对于给定的仪器,读数误差ΔT为一常数
1086420204060800.70.40.20.1AT/%Er(36.8)0.434实际工作中,应控制T在15~65%,A在0.2~0.8之间(调c,b,)因此,在不同的吸光度范围内仪器读数对测定带来不同程度的误差,根据计算结果作图
3、仪器狭逢宽度的选择狭逢宽度过大,入射光的单色性降低狭逢宽度过小,光强变弱。在不引起吸光度减小的情况下,尽量选取最大的狭逢宽度。
三、显色反应及显色条件的选择可见光区的吸光光度分析,首先要利用显色反应将待测组分转变为有色物质,然后进行测定。显色剂:将待测组分转变为有色物质的化学试剂M+RMR被测组分有色物质显色剂
1.灵敏度高,ε大。2.选择性好,干扰少。3.显色后的物质组成恒定,化学性质稳定。4.有色物质与显色剂颜色差别大。显色剂在测定波长处无明显吸收,Δmax>60nm;M+RMR对显色反应的要求
影响因素显色条件的选择M+RMROH-M(OH)nH+HnR显色剂用量酸度温度显色时间溶剂溶液中共存离子
1.显色剂用量为使显色反应完全,需加入过量的显色剂,但有时显色剂太多,引起副反应,用量通过实验选择。固定c(M)、pH,改变c(R):c(R)c(R)c(R)Mo(SCN)32+浅红Mo(SCN)5橙红Mo(SCN)6-浅红Fe(SCN)n3-n
2.显色反应酸度pH酸度对显色反应有影响,要控制合适的酸度,通过实验确定。固定c(M)、c(R),改变pH
25℃50℃t/minA3.显色温度及显色时间显色反应要在合适的温度下进行;有的显色反应瞬间完成,有的需要放置一定时间。有的放置时间太长不稳定,通过实验选择。固定c(M)、c(R)、pH,改变温度和时间
四、参比溶液的选择吸光度的测量:将被测溶液盛放在吸收池中,放入分光光度计光路中。如图所示:MR吸收试样中其他成分吸收溶剂和试剂吸收吸收池对光的反射和吸收A=lg(I0/It)
目的是为了消除由于比色皿、溶剂及试剂对入射光的反射和吸收等带来的误差。A(样品)=A(MR)+A(干扰)+A(吸收池)A(参比)=A(干扰)+A(池)=0为了使吸光度真正反映待测组分的浓度,需扣除非待测组分的影响——使用参比溶液参比溶液:将不含待测离子的溶液或试剂加入一比色皿中,试液放入另一比色皿中,再调节仪器,使不含待测离子溶液处于T=100%(A=0)处,此种溶液为参比溶液。A(样品)-A(参比)=A(MR)=kbc
参比溶液的选择(1)如果仅待测物与显色剂的反应产物有吸收,可用纯溶剂(或蒸馏水)作参比溶液(2)如果显色剂或其他试剂略有吸收,应用空白溶液(包括显色剂或其它试剂不加待测试样溶液)作为参比溶液。(3)如试样中其它组分有吸收,但不与显色剂反应,则当显色剂无吸收时,可用试样溶液作为参比溶液;当显色剂略有吸收时,可在试液中加入适当掩蔽剂将待测组分掩蔽后再加显色剂,以此溶液作参比溶液。
五、干扰及消除方法共存离子有色或显色剂反应生成有色物质干扰测定,需设法消除或提前分离之。消除方法有:1、控制酸度2、选择适当的掩蔽剂选择掩蔽剂的原则是:掩蔽剂不与待测组分反应;掩蔽剂本身及掩蔽剂与干扰组分的反应产物不干扰待测组分的测定。
例:测定Ti4+,加入H3PO4掩蔽剂使Fe3+(黄色)成为[Fe(PO4)2]3-(无色),消除Fe3+的干扰。采用适当的分离方法预先除去干扰物质。
3.利用惰性配合物4.选择适宜的波长避开干扰物的最大吸收,配制适当的参比液,消除干扰组分的影响。5.分离干扰离子采用适当的分离方法预先除去干扰物质。
可见分光光度法思考题1.朗伯-比耳定律的物理意义是什么?写出其数学表达式。2.摩尔吸光系数ε的物理意义是什么?其大小与哪些因素有关?ε在分析化学中有何意义?3.什么是吸收曲线?什么是标准曲线?它们有何实际意义?4.显色反应如何选择?5.吸光度测量条件如何选择?6.光度分析法中,参比溶液应如何选择?7.示差光度法的测定原理是什么?如何用示差光度法进行定量分析?答案
1.答:当一束平行的单色光通过液层厚度为b的有色溶液时,溶液的吸光度A与液层的厚度b和溶液的浓度c成正比。即A=lg(I0/I)=εbc2.答:摩尔吸光系数ε在数值上等于1mol·L-1吸光物质在1cm光程中的吸光度。它是吸光物质在特定波长下的一个特征常数。其单位为L·mol-1·cm-1。由于ε值与入射光波长有关,故表示ε时,应注明所用入射光波长。在分析化学中,ε值的大小反应了:(1)吸光物质对某一特定波长光吸光能力大小的量度。ε值越大,该吸光物质的吸光能力越强。(2)衡量光度分析方法灵敏度的重要指标,ε值越大,方法的灵敏度越高。
3.答:以入射光波长作横坐标,用分光光度计测量每一波长下物质对光的吸光度作纵坐标所绘制的曲线,称为吸收曲线。其作用是:选择入射光波长,在此波长下测量吸光度,则分析的灵敏度最高。因此,吸收曲线是吸光光度法中选择测定波长的重要依据。在某特定波长下,用分光光度计测量一系列不同浓度的标准溶液的吸光度,然后以浓度为横坐标,对应的吸光度值为纵坐标所绘制的曲线,称为标准曲线(亦称工作曲线)。它是作为待测物质定量分析的依据。如果在相同条件下测得待测试液的吸光度值,从标准曲线上就可查得待测试液的浓度,这就是标准曲线法。
4.答:显色反应的选择原则是:(1)选择生成的有色物质(MR)的ε较大的显色反应;(2)显色剂(R)在测定波长处无吸收,即ε尽可能小;(3)反应生成的有色物质(MR)的组成要恒定,化学性质稳定。5.答:吸光度测量条件包括三个主要方面:(1)入射光波长的选择:入射光的波长应根据吸收曲线选择λmax为宜。因在此波长处ε值最大,使测定具有较高的灵敏度。(2)参比溶液的选择:在吸光度的测量中,由于比色皿的反射以及溶剂、试剂等对光的吸收,使得
测得的吸光度值不能真实地反映待测物质对光的吸收,也就不能真实地反映待测物质的浓度。为了校正上述影响需要正确选择参比溶液。通过调节仪器使参比溶液的吸光度为零(A=0),或透光度T=100%。借此消除上述影响。(3)吸光度读数范围的选择吸光度值太大或太小时,读数波动所引起的吸光度读数误差较大,为了减小读数误差,应使测量的吸光度值控制在A=0.15~1.0(或透光度T在75%~10%)范围之内。可以采用以下措施:(a)控制溶液的浓度,如改变试样的称量,或改变溶液的稀释度等;(b)选择不同厚度的比色皿,以改变光程的长度。
6.答:参比溶液的选择原则如下:(1)若仅待测物(M)与显色剂(R)的反应产物(MR)有吸收,可用蒸馏水作参比溶液。(2)若待测物(M)无吸收,而显色剂(R)或其它试剂(R′)有吸收,则用不加试样的空白溶液作参比溶液。(3)若试样中的其它组分有吸收(待测物M之外的组分,如N),但不与显色剂反应,当显色剂无吸收时,可用试样溶液作参比溶液;当显色剂有吸收时,可在试液中加入适当掩蔽剂将待测组分掩蔽后再加显色剂,以此溶液作参比溶液。总之,选择参比溶液的原则是:应使测得的试液的吸光度能真正反映待测物的浓度。
7.答:示差光度法是用一个比被测试液浓度(cx)稍低的标准溶液(cs)作参比溶液与试液进行比较。以cs作参比溶液,调节仪器透光度读数为100%(A=0),测得的吸光度是试液与参比溶液的吸光度差值(称为相对吸光度),即ΔA=εb(cx-cs)=εbΔc。由此可知,被测试液与参比溶液的吸光度差值(ΔA)与两溶液浓度之差(Δc)成正比,这就是示差光度法的基本原理。示差光度法常采用标准曲线法进行定量分析。以上述浓度为cs的标准溶液作参比溶液,测定一系列Δc已知的标准溶液的相对吸光度ΔA,绘制ΔA~Δc工作曲线,再测未知液的相对吸光度ΔA,由工作曲线查出相应的Δc,经换算cx=cs+Δc,即为所求。
中国公民健康素养---基本知识与技能释义伊宁县第二中学
中国公民健康素养66条·基本知识和理念(25条)·健康生活方式与行为(29条)·基本技能(12条)
(一)、基本知识和理念(25条)1.健康不仅仅是没有疾病或虚弱,而是身体、心理和社会适应的完好状态。2.每个人都有维护自身和他人健康的责任,健康的生活方式能够维护和促进自身健康。3.环境与健康息息相关,保护环境,促进健康。4.无偿献血,助人利己。5.每个人都应当关爱、帮助、不歧视病残人员。6.定期进行健康体检。
7.成年人的正常血压为收缩压≥90mmHg且<140mmHg,舒张压≥60mmHg且<90mmHg;腋下体温36℃~37℃;平静呼吸16~20次/分;心率60~100次/分。8.接种疫苗是预防一些传染病最有效、最经济的措施,儿童出生后应当按照免疫程序接种疫苗。9.在流感流行季节前接种流感疫苗可减少患流感的机会或减轻患流感后的症状。10.艾滋病、乙肝和丙肝通过血液、性接触和母婴三种途径传播,日常生活和工作接触不会传播。
11.肺结核主要通过病人咳嗽、打喷嚏、大声说话等产生的飞沫传播;出现咳嗽、咳痰2周以上,或痰中带血,应当及时检查是否得了肺结核。12.坚持规范治疗,大部分肺结核病人能够治愈,并能有效预防耐药结核的产生。13.在血吸虫病流行区,应当尽量避免接触疫水;接触疫水后,应当及时进行检查或接受预防性治疗。14.家养犬、猫应当接种兽用狂犬病疫苗;人被犬、猫抓伤、咬伤后,应当立即冲洗伤口,并尽快注射抗狂犬病免疫球蛋白(或血清)和人用狂犬病疫苗。15.蚊子、苍蝇、老鼠、蟑螂等会传播疾病。
16.发现病死禽畜要报告,不加工、不食用病死禽畜,不食用野生动物。17.关注血压变化,控制高血压危险因素,高血压患者要学会自我健康管理。18.关注血糖变化,控制糖尿病危险因素,糖尿病患者应当加强自我健康管理。19.积极参加癌症筛查,及早发现癌症和癌前病变。20.每个人都可能出现抑郁和焦虑情绪,正确认识抑郁症和焦虑症。
21.关爱老年人,预防老年人跌倒,识别老年期痴呆。22.选择安全、高效的避孕措施,减少人工流产,关爱妇女生殖健康。23.保健食品不是药品,正确选用保健食品。24.劳动者要了解工作岗位和工作环境中存在的危害因素,遵守操作规程,注意个人防护,避免职业伤害。25.从事有毒有害工种的劳动者享有职业保护的权利。
(二)、健康生活方式与行为(29条)26.健康生活方式主要包括合理膳食、适量运动、戒烟限酒、心理平衡四个方面。27.保持正常体重,避免超重与肥胖。28.膳食应当以谷类为主,多吃蔬菜、水果和薯类,注意荤素、粗细搭配。29.提倡每天食用奶类、豆类及其制品。30.膳食要清淡,要少油、少盐、少糖,食用合格碘盐。
31.讲究饮水卫生,每天适量饮水。32.生、熟食品要分开存放和加工,生吃蔬菜水果要洗净,不吃变质、超过保质期的食品。33.成年人每日应当进行6~10千步当量的身体活动,动则有益,贵在坚持。34.吸烟和二手烟暴露会导致癌症、心血管疾病、呼吸系统疾病等多种疾病。35.“低焦油卷烟”、“中草药卷烟”不能降低吸烟带来的危害。
36.任何年龄戒烟均可获益,戒烟越早越好,戒烟门诊可提供专业戒烟服务。37.少饮酒,不酗酒。38.遵医嘱使用镇静催眠药和镇痛药等成瘾性药物,预防药物依赖。39.拒绝毒品。40.劳逸结合,每天保证7~8小时睡眠。
41.重视和维护心理健康,遇到心理问题时应当主动寻求帮助。42.勤洗手、常洗澡、早晚刷牙、饭后漱口,不共用毛巾和洗漱用品。43.根据天气变化和空气质量,适时开窗通风,保持室内空气流通。44.不在公共场所吸烟、吐痰,咳嗽、打喷嚏时遮掩口鼻。45.农村使用卫生厕所,管理好人畜粪便。
46.科学就医,及时就诊,遵医嘱治疗,理性对待诊疗结果。47.合理用药,能口服不肌注,能肌注不输液,在医生指导下使用抗生素。48.戴头盔、系安全带,不超速、不酒驾、不疲劳驾驶,减少道路交通伤害。49.加强看护和教育,避免儿童接近危险水域,预防溺水。50.冬季取暖注意通风,谨防煤气中毒。
51.主动接受婚前和孕前保健,孕期应当至少接受5次产前检查并住院分娩。52.孩子出生后应当尽早开始母乳喂养,满6个月时合理添加辅食。53.通过亲子交流、玩耍促进儿童早期发展,发现心理行为发育问题要尽早干预。54.青少年处于身心发展的关键时期,要培养健康的行为生活方式,预防近视、超重与肥胖,避免网络成瘾和过早性行为。
(三)、基本技能(12条)55.关注健康信息,能够获取、理解、甄别、应用健康信息。56.能看懂食品、药品、保健品的标签和说明书。57.会识别常见的危险标识,如高压、易燃、易爆、剧毒、放射性、生物安全等,远离危险物。58.会测量脉搏和腋下体温。59.会正确使用安全套,减少感染艾滋病、性病的危险,防止意外怀孕。60.妥善存放和正确使用农药等有毒物品,谨防儿童接触。
61.寻求紧急医疗救助时拨打120,寻求健康咨询服务时拨打12320。62.发生创伤出血量较多时,应当立即止血、包扎;对怀疑骨折的伤员不要轻易搬动。63.遇到呼吸、心跳骤停的伤病员,会进行心肺复苏。64.抢救触电者时,要首先切断电源,不要直接接触触电者。65.发生火灾时,用湿毛巾捂住口鼻、低姿逃生;拨打火警电话119。66.发生地震时,选择正确避震方式,震后立即开展自救互救。
健康不仅仅是没有疾病,而是身体、心理和社会适应的完好状态。祝愿我们每个人都拥有健康的人生'
您可能关注的文档
- 最新系统解剖学-13.视器课件PPT.ppt
- 最新素描入门基础课件PPT.ppt
- 最新系统集成商的发展与危机课件PPT.ppt
- 最新素问·咳论(9)课件PPT.ppt
- 最新素问·咳论(3)课件PPT.ppt
- 最新素质与修养——心态课件PPT.ppt
- 最新素描课件PPT.ppt
- 最新紫外——可见分光光度法-教学课件PPT教学讲义ppt.ppt
- 最新素问厥论课件PPT.ppt
- 最新紫外分光法B药学(完整版)课件PPT.ppt
- 最新累积型战略课件PPT.ppt
- 最新红外传感器课件模板课件PPT.ppt
- 最新红斑及红斑鳞屑性皮肤病.课件PPT.ppt
- 最新红楼梦林黛玉进贾府路线图课件PPT.ppt
- 最新红桑,狗牙花,龟背竹,红背桂袋苗之园林绿化苗木贵州报价课件PPT.ppt
- 最新红色经典故事PPT课件PPT.ppt
- 最新约束理论的观点课件PPT.ppt
- 最新级操作技能背诵内容课件PPT.ppt